APIE

Biochemijos ir molekulinės biologijos katedra gyvuoja nuo 2012 m., kai Vilniaus universiteto Gamtos mokslų fakulteto Biochemijos ir biofizikos katedra (įkurta 1962 m.) pasidalijo į dvi – Biochemijos ir molekulinės biologijos bei Neurobiologijos ir biofizikos katedras.
Džiaugiamės ir didžiuojamės šimtais katedros absolventų – biochemikų ir molekulinių biologų – kurie darbuojasi Vilniaus universitete, Lietuvos bei užsienio universitetuose ir mokslo centruose, verslo įmonėse, valstybinėse įstaigose, garsina Lietuvą savo pasiekimais mokslo, technologijų ir inovacijų srityse.
Mes dalyvaujame vykdant I-III pakopų biochemijos ir I-II pakopų molekulinės biologijos studijas Vilniaus universitete, o katedros mokslininkai atlieka tyrimus biochemijos, molekulinės biologijos ir ląstelės biologijos srityse.
Biochemijos ir molekulinės katedros archyvas iki 2017 m. pasiekiamas http://www.bmbk.gf.vu.lt/
TYRIMAI
Bakterijų atsparumo antibiotikams molekuliniai mechanizmai, streso atsakai ir patogenezė
Grupės vadovai

Prof. Edita Sužiedėlienė
Prof. Julija Armalytė
Dr. Jūratė Skerniškytė
Bendradarbiavimas (VU Fizikos fakultetas): Dr. Irina Buchovec
Grupės nariai
Dr. Danutė Labeikytė
Doc. Arvydas Markuckas
Prof. Kęstutis Sužiedėlis
Ramutė Pagalytė
Doktorantai
Laurita Klimkaitė
Tomas Liveikis
Ignas Ragaišis
Tyrimų kryptys
Pasaulio ir Lietuvos ligoninėse plinta antibiotikams atsparios bakterijos, kurių sukeltų infekcijų gydymas tampa sudėtingas dėl vis didėjančio atsparumo beveik visų klasių antibiotikams. Mes tiriame oportunistinių patogeninių bakterijų atsparumo naujų kartų antibiotikams ir virulentiškumo molekulinius mechanizmus, jų įvairovę, paplitimą, evoliuciją klinikinėje ir gamtinėje aplinkoje, siekiame suprasti, kaip infekcijų sukėlėjai prisitaiko prie šeimininko ir aplinkos, ieškome naujų taikinių ir antimikrobinio poveikio būdų.
Atsparumo antibiotikams genetinių determinančių plitimas ir evoliucija klinikoje ir aplinkoje
Antibiotikams atsparių bakterijų sukeliamos infekcijos kelia grėsmę sveikatos apsaugai visame pasaulyje. Problemą aštrina oportunistiniai patogenai – anksčiau laikytos nepatogeninėmis bakterijos, dėl savo gebėjimo įgyti atsparumą daugeliui antibiotikų, taip pat dėl kitų virulentiškumo veiksnių tampančios vienais svarbiausių infekcijų sukėlėjų ligoninėse. Mes tiriame oportunistinių patogenų Acinetobacter baumannii ir Stenotrophomonas maltophilia atsparumo antibiotikams ir virulentiškumo molekulinius mechanizmus. A. baumannii jau seniai įsitvirtinęs kaip vienas iš kritinių hospitalines infekcijas sukeliančių patogenų. Šios bakterijos ypač greitai įgyja atsparumą naujų kartų antibiotikams ir ilgai išlieka ligoninių aplinkoje. S. maltophilia – aplinkoje gyvenanti bakterija, tačiau vis dažniau sukelianti sunkiai gydomas hospitalines infekcijas. Sėkmingiausi oportunistiniai patogenai dažnai pasižymi ir dideliu genomo plastiškumu bei gebėjimu dalintis genetine medžiaga, tokiu būdu greitai įgydami atsparumo antibiotikams ir kitus virulentiškumo genus. Mus domina kaip kinta ir įsitvirtina šios patogenų savybės klinikinėje ir gamtinėje aplinkoje.
Oportunistinių bakterijų ir įgimto imuniteto sąveika
Bakteriniai patogenai sukelia infekcijas pasitelkdami išvystytus patogenezės būdus. Mūsų atliekami tyrimai atskleidė dvi savybes, svarbias oportunistinių bakterijų patogenezei: 1) kapsulės polisacharidus (capsular polysaccharides, CPS) ir 2) išorinės membranos pūsleles (outer membrane vesicles, OMV). Parodėme, kad CPS gali efektyviai apsaugoti A. baumannii nuo aplinkos stresinių veikslių ir imuninių ląstelių fagocitozės. A. baumannii produkuoja OMV, jose inkapsuliuodamos antibiotikus skaidančius fermentus. Tokiu būdu bakterijos, sekretuodamos OMV gali inaktyvuoti antimikrobines medžiagas per atstumą. Nustatėme, kad OMV taip pat gali moduliuoti uždegiminį atsaką makrofaguose. Mūsų tikslas – suprasti, kaip bakterijos, pasitelkdamos CPS ir OMV, moduliuoja imuninį atsaką infekcijos metu.
Alternatyvūs kovos su antibiotikams atspariais mikroorganizmais metodai
Antimikrobinė fotodinaminė terapija (antimicrobial photodynamic therapy, aPDT ) – tai biofotoninė technologija, kuri gali būti naudojama kaip papildoma arba alternatyvi gydymui antibiotikais strategija. Ji pagrįsta fotosensibilizatoriaus, molekulinio deguonies ir mažų šviesos dozių sąveika, kuri generuoja aktyvias deguonies formas, pažeidžiančias bakterijų ląsteles. Parodėme, kad fotosensibilizatoriais – chlorofilinu (Chl), riboflavinu (Rf),5-aminolevulino rūgštimi (ALA) paremta aPDT naikina A. baumannii ir S. maltophilia bakterijų formuojamas bioplėveles. Siekdami padidinti poveikį prieš šias bakterijų formuojamas struktūras, ieškome kombinuotų poveikio būdų, pvz., aPDT deriname su antibiotikais, taip siekdami visiškai neutralizuoti bioplėveles ir išvengti infekcijos pasikartojimo.
Mikroorganizmų įvairovė ir atsparumo antibiotikams plitimas aplinkoje
Didelė mikroorganizmų įvairovė sutinkama visose ekologinėse nišose, kur jie atlieka savitas funkcijas. Tačiau dirvožemio, vandens ir kitų buveinių biologinė įvairovė gali būti paveikta žmogaus veiklos, paliečiančios ir nusistovėjusius gamtinius procesus. Be to, kad dirvožemio ar vandens telkinių bioįvairovės palaikymas ir pritaikymas žemės ūkio tikslams yra svarbus ekonomiškai, šios ekologinės nišos taip pat gali tapti palankia aplinka atsparumo antimikrobinėms medžiagoms evoliucijai ir vystymuisi. Savo tyrimuose siekiame įvertinti mikroorganizmų įvairovę skirtingose aplinkose (pvz., intensyvaus ūkininkavimo ar užteršta dirva, akvakultūrai naudojami vandens telkiniai), daugiausia dėmesio skirdami klinikoje svarbių atsparumo antibiotikams genų paplitimui. Atsparumo antibiotikams genų įvairovės ir jų mobilizavimo potencialo palyginimas įvairiose aplinkos galėtų pasitarnauti antropogeninės veiklos poveikio ekosistemoms, o taip pat atsparumo antibiotikams grėsmės vertinimui.
Žmogaus kvėpavimo takų mikrobiomo tyrimai
Vis daugiau tyrimų atskleidžia žmogaus mikrobiomo įvairovę. Prie gausių žarnyno, odos mikrobiomo tyrimų prisideda ir kvėpavimo takų mikrobiomų analizė. Vis dėlto sveiko ar sutrikusio mikrobiomo sudėtis ir poveikis kvėpavimo takų sveikatai bei jo sąveika su šeimininku tik pradedama aiškinti. Savo tyrime siekiame tirti viršutiniuose kvėpavimo takuose randamų mikroorganizmų įvairovę, pasirinkę šią lokalizaciją kaip mažiau invazinę alternatyvą plaučių sveikatai tirti. Viršutinių ir apatinių kvėpavimo takų mikroorganizmų įvairovę nustatome atlikdami viso ilgio 16S rRNR geno amplikonų sekoskaitą, naudojant „Oxford Nanopore“ technologijas.
Projektai
Mokslininkų grupių projektas "Lietuvos tuberkulioze sergančių ligonių plaučių mikrobiomo tyrimas" (S-MIP-24-70), projekto vykdytoja dr. J. Armalytė (2024-2027).
Mokslininkų grupių projektas “Kapsulės polisacharidų ir išorinės membranos pūslelių vaidmens oportunistinių bakterijų patogenezėje tyrimas” (S-MIP-23-109), projekto vadovė dr. J. Skerniškytė (2023-2026).
Vilniaus universiteto mokslo skatinimo fondo projektas “Bakterijų išorinės membranos pūslelių pritaikymas antibiotikų ir fotoaktyvių medžiagų pernašai taikant kombinuotą terapiją prieš oportunistinių bakterijų formuojamas bioplėveles” (MSF-JM-04/2024), projekto vadovė dr. J. Skerniškytė, vykdytoja dr. I. Buchovec (2024-2025).
Vilniaus universiteto mokslo skatinimo fondo projektas “Oportunistinių patogenų Acinetobacter baumannii ir Stenotrophomonas maltophilia atsparumo antibiotikams genetinių determinančių paplitimo tyrimas“ (MSF-JM-12/2023), projekto vadovė L. Klimkaitė, projekto vykdytojas T. Liveikis (2023-2024).
Vilniaus universiteto mokslo skatinimo fondo projektas “Sinergistinės antibiotikų-fotodinaminės terapijos pritaikymas oportunistinio patogeno Stenotrophomonas maltophilia inaktyvacijai” (MSF-JM-3/2021), projekto vadovė dr. I. Buchovec, projekto vykdytoja L. Klimkaitė (2021-2022).
ES fondų investicijų veiksmų programos 1 prioriteto ,,Mokslinių tyrimų, eksperimentinės plėtros ir inovacijų skatinimas “ 01.2.2-LMT-K-718 priemonės ,,Tiksliniai moksliniai tyrimai sumanios specializacijos srityje” projektas „Individualizuoti viršutinių kvėpavimo takų mikrobiomo tyrimai - naujas diagnostinis ir sveikatos priežiūros įrankis (YourAirwayMicrobiome)“ (01.2.2-LMT-K-718-03-0079), (bendradarbiaujant su IMC ir VUL SK) VU ats. vykdytoja dr. J. Armalytė (2020-2023).
Nacionalinė mokslo programos “Sveikas senėjimas” projektas „Vakcinos prieš hospitalinį patogeną Acinetobacter baumannii kūrimas“ (S-SEN20-1), projekto vadovė dr. J. Armalytė (2020–2021).
Nacionalinės mokslo programos „Agro, miško ir vandens ekosistemų tvarumas“ projektas „Intensyvios žuvininkystės poveikis vandens telkinių mikrobiomui ir rezistomui“ (S-SIT-20-6), projekto vykdytoja dr. J. Armalytė (2020–2021).
Nukleorūgščių biochemijos laboratorija
Grupės vadovas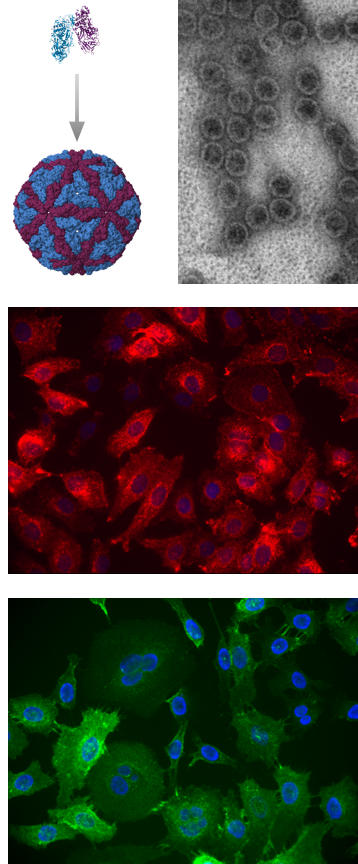
Prof. Saulius Serva
Grupės nariai
Dr. Aleksandras Konovalovas
Dr. Algirdas Mikalkėnas
Dr. Enrika Celitan
Doktorantai
Gerda Skinderytė
Mehvish Mumtaz
Tyrimų kryptys
Grupė aktyviai užsiima tyrimais, orientuotais į dvi pagrindines kryptis:
- Molekuliniai mielių Saccharomyces natyvių virusų mechanizmai
Dvigrandės RNR virusai yra plačiai paplitę, tačiau mažai ištirti mielėse aptinkami joms nekenksmingi organizmai. Supratimas apie virusų ir šeimininkų santykius ląstelės viduje ir už jos ribų yra labai svarbus, siekiant išsiaiškinti virusų evoliucijos kelią ir atskleisti jų vaidmenį ekosistemoje. Šiam tikslui pasiekti tiriamas grybų dsRNA virusų įvairovė ir funkcijos, pradedant jų identifikavimu natūraliuose šeimininkuose ir tęsiant išsamius tyrimus mūsų laboratorijoje.
Mūsų komanda taiko sistemų biologijos metodus, siekdama atskleisti mielių dvigrandžių RNR virusų sąveiką su šeimininko ląstele. Sukurtos technologijos leidžia atlikti genomikos, transkriptomikos, proteomikos, fenomikos ir struktūrinę analizes, kurių tikslas – suprasti molekulinius mechanizmus, lemiančius mielių virusų sąveiką su šeimininko ląstele.
- Dvigrandžių RNR virusų kapsidžių taikymas vaistų pernašai palengvinti
Be fundamentalių tyrimų, plėtojame mielių virusų taikymo perspektyvas. Virusų kapsidžių inžinerija, jų paruošimas ir taikymas vaistų pernašai palengvinti yra aktyviai vystoma kryptis, siekiant sukurti pažangias biomedicinines pritaikymo galimybes.
Metodai
Laboratorijoje naudojami įvairūs metodai, nuo klasikinių iki pačių naujausių. Mes taikome mikrobiologijos, genų ir genomų inžinerijos, naujos kartos DNR ir RNR sekoskaitos (Illumina ir Oxford Nanopore), bioinformatikos, enzimologijos, pažangiosios mikroskopijos ir struktūrinės analizės, ląstelių kultūrų ir kitas technologijas.
Projektai (nuo 2020)
Lietuvos mokslo taryba: “Microcosmos of flower and honey bee drones and sustainable control of hive health (MICROCOSMOS)”, No. S-MIP-24-55, 2024-2027.
Lietuvos mokslo taryba: “Lung microbiome study of Lithuanian tuberculosis patients”, No. S-MIP-24-70, 2024-2027.
Vilniaus universiteto Pažangos įniciatyvos programa: “Data Center for Machine Learning and Quantum Computing in Natural and Biomedical Sciences”, No.: S-A-UEI-23-11, 2023-2027.
Lietuvos mokslo taryba: “Facilitated delivery of bioactive compounds: versatile toolkit for biomedical applications (DECORATION)”, No. S-MIP-23-28, 2023-2026.
Lietuvos mokslo taryba: “Linkage of biocidal phenomenon of natural yeast and native antiviral systems”, No. S-ST-23-92, 2023-2024.
Lietuvos mokslo taryba: “Biocontrol of wild berry microbiota composition by yeast counterpart (CONFIDENT)”, P-PD-22-058, 2022-2024.
Vilniaus universiteto Mokslo vystymo programa: “DNA Engineering Tools for Pathogen Identification in Bioarchaeological Samples”, MSF-JM-14/2022, 2022-2023.
VU GMC-EMBL Partnerystės Instituto Asocijuotų tyrimų programa: “CRISPR-Based Enrichment Strategy for Targeted Long-Read Sequencing”, 2022-2023.
Lietuvos mokslo taryba: “Individualized Nasal Microbiome Test – Novel Tool for Diagnostics and Health Care (YourAirwayMicrobiome)”, 01.2.2-LMT-K-718-03-0079, 2021-2023.
Švietimo, mokslo ir sporto ministerija, Reikminių tyrimų programa: “System for virus spread control and extreme situation management during COVID-19 epidemics”, Nr. S-DNR-20-2 (2021).
Lietuvos mokslo taryba: “Viractome - integrative approach for functional yeast virus analysis”, No. 09.3.3-LMT-K-712-19-0157, 2020-2022.
Europos mokslo ir technologijų bendradarbiavimo (COST) veikla CA17103: “Delivery of antisense RNA therapeutics (DARTER)”, P-COST-20-3, 2020-2022.
Lietuvos mokslo taryba: “Chemical Annotation in the Crystallography Open Database (COD)”, S-MIP-20-21, 2020-2022.
Vilniaus Universiteto Mokslo skatinimo programa: „Investigation of Totiviridae family virus ScV-LA biogenesis in native environment“, Nr. MSF-JM-7, 2019-2020.
ES Horizon 2020 Tyrimų ir inovacijų programa: “Sonic drilling coupled with automated mineralogy and chemistry On-Line-On-Mine-Real-Time (SOLSA)”, 2016-2020.
Atsparumo priešvėžiniam poveikiui molekulinių mechanizmų tyrimai
Grupės vadovė
Dr. Aušra Sasnauskienė
Grupės nariai
Dr. Violeta Jonušienė
Dr. Daiva Dabkevičienė
Vilmantė Žitkutė
Eglė Žalytė
Tyrimų kryptys
Mūsų grupėje vykdomi dviejų krypčių tyrimai:
• Atsparumo priešvėžiniam poveikiui molekulinių mechanizmų tyrimai;
• Žmogaus pirminių ląstelių funkciniai tyrimai.
Atsparumo priešvėžiniam poveikiui molekulinių mechanizmų tyrimai
Įgytas vėžinių ląstelių atsparumas vaistams riboja priešvėžinės terapijos efektyvumą. Ląstelių atsparumą gali sukelti įvairios priežastys: vaistų pernašos ir metabolizmo pokyčiai, vaistų taikinių modifikacijos, suaktyvėjusi DNR reparacija ar ląstelių žūties iniciacijos pokyčiai.
Atsparių ląstelių funkcinė analizė leidžia identifikuoti naujus taikinius atsparumui sumažinti. Mes tiriame vėžinių ląstelių molekulinius pokyčius, reguliuojančius ląstelių žūties ir išgyvenimo signalus ir sukeliančius atsparumą priešvėžinei terapijai. Analizuojame molekulinius mechanizmus, lemiančius atsparumą chemoterapiniams vaistams, taikinių terapijos agentams bei imuninės patikros slopikliams. Siekiame nustatyti galimus priešvėžinės terapijos taikinius kolorektalinio ir endometriumo vėžio ląstelėse.
Bendradarbiaudami su VU GMC Biochemijos instituto mokslininkais, tiriame bakteriofagų kilmės nanovamzdelių, kaip galimų vaistų nešiklių, panaudojimą; vertiname jų patekimo ir pernašos vėžinėse ląstelėse mechanizmus.
Žmogaus pirminių ląstelių funkciniai tyrimai
Bendradarbiaudami su VU Medicinos fakulteto Biomedicinos mokslų instituto mokslininkais, atliekame retomis genetinėmis ligomis sergančių žmonių pirminių ląstelių tyrimus. Siekiame įvertinti pirminių ląstelių funkcines ypatybes, susiejant jas su genomo ir transkriptomo pokyčiais.
Metodai
Ląstelių kultūrų ir pirminių ląstelių kultivavimas 2D ir 3D sistemose; baltymų imunofermentinės analizės metodai: Western blot analizė, ELISA; kiekybinė PGR; viduląstelinės lokalizacijos vertinimas naudojant konfokalinę mikroskopiją; tėkmės citometrija; genų raiškos funkcinė analizė, naudojant siRNR ir CRISPR-Cas metodus.
Projektai (nuo 2017 m.)
Vilniaus universiteto mokslo skatinimo fondo projektas „CRISPR-Cas13 technologijos taikymas tiriant atsparumą chemoterapiniams vaistams“, Nr. MSF-JM-2/2021. Projekto vadovė V. Žitkutė (2021-2022).
Lietuvos mokslo tarybos Nacionalinės mokslo programos „Sveikas senėjimas“ projektas „Savaime susirenkantys fagų baltymai tikslinei nanomedicinai“, Nr. S-SEN 20-4. Projekto dalyviai: A. Sasnauskienė, V. Žitkutė (2020-2021).
Vilniaus universiteto mokslo skatinimo fondo projektas „Genomo ir transkriptomo analizė retų paveldimų ligų patogenezės tyrimuose“, Nr. MSF-JM-2/2020. Projekto dalyvė A. Sasnauskienė (2020).
Lietuvos mokslo tarybos projektas „Aromatinių nitrojunginių ir n-oksidų redokso chemija, biochemija ir citotoksiškumas: nauji požiūriai“, Nr. DOTSUT-34/09.33-LMT-K712-01-0058. Projekto dalyvė V. Jonušienė (2018–2021).
Lietuvos mokslo tarybos Nacionalinės mokslo programos „Sveikas senėjimas“ projektas „Nauji žymenys storosios žarnos vėžio individualizuotai terapijai: proteomika, mikroRNRomika, klinika“, Nr. SEN-17/2015. Projekto dalyviai: V. Jonušienė, A. Sasnauskienė (2015-2018).
Molekuliniai viduląstelinės pernašos mechanizmai
Grupės vadovė
Prof. Vytautė Starkuvienė Erfle
Tyrimai
Viduląstelinės pernašos mechanizmai perskirsto naujai susintetintas arba į ląstelę patekusias medžiagas ir yra vieni iš svarbiausių veiksnių, nulemiančių ląstelės homeostazę. Netiksli pernaša sukelia visą eilę plačiai paplitusių ligų: pradedant nuo vėžinių susirgimų baigiant širdies-kraujagyslių ligomis. Baltymų pernaša taip pat prisideda prie ląstelių differenciacijos ir senėjimo procesų. Viduląstelinės pernašos mechanizmus galima suskirstyti į keletą etapų: sekreciniai mechanizmai, kurių metu baltymai yra pernešami iš viduląstelinio tinklo į Goldžio kompleksą, o iš jo plazminę membraną, lizosomas arba ląstelės išorę. Įvairūs ligandai, augimo faktoriai, virusai patenka į ląstelę endocitozės būdu. Tiek sekreciniai, tiek endocitozės keliai yra glaudžiai susiję su degradacija, autofagija, žūtimi, mitoze, streso atsaku, o taip pat ir transkripcijos bei transliacijos reguliacija. Mūsų darbo tikslas yra išsiaiškinti, kaip baltymų pernaša endocitozės metu reaguoja į pakitimus ląstelės išorėje ir atitinkamai adaptuojasi. Tyrimai yra vykdomi Vilniaus ir Heidelberg (Vokietija) Universitetuose.
Metodai
Tyrimai atliekami naudojantis ląstelės biologijos, molekulinės genetikos ir biochemijos metodais. Ypatingai svarbūs yra didelės raiškos ir didelio našumo fluorescencinės mikroskopijos metodai. Didžiąja dalimi mes dirbame su vėžinėmis ir sveikomis pirminėmis ląstelėmis 2D ir 3D aplinkose; ir keičiame jų savybes naudojantis „gene editing“ metodais, RNRi, vaistais ir antikūniais. Dalis projektų yra skirta naujų metodų sukūrimui, kurie padėtų modifikuoti ir analizuoti viduląstelinius pernašos mechanizmus nesukeliant pašalinių efektų.
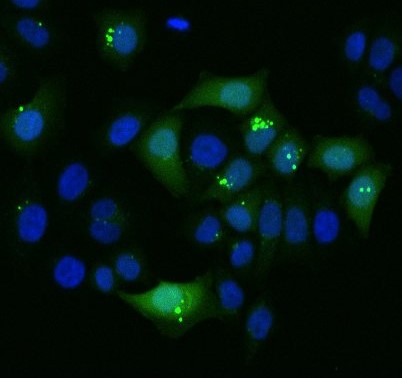
Endocitozės kompleksiškumas nulemia ląstelių sąvybių keitimo efektyvumą
Cargo patekimas į ląstelę yra tiesiogiai priklausomas nuo endocitozės, kurios efektyvumas skiriasi individualiose ląstelėse. GFP baltymas į kai kurias ląsteles patenka efektyviai ir lokalizuojasi citoplazmoje. Tuo tarpu, dalis ląstelių šio baltymo visai neinternalizuoja. Dalis ląstelių sugeba GFP pasiimti, tačiau jis lieka endosomose.
Eksperimentas: Dr S. Liechocki, Heidelberg Universitetas.
PAGRINDINĖS PUBLIKACIJOS

Bakterijų atsparumo antibiotikams molekuliniai mechanizmai, streso atsakai ir patogenezė:
Skerniskyte J., Barroso M.V., Chicher J., Hammann P., Demais V., Wright K., Mostowy S., Marteyn B.S. (2025) Neutrophils display antibacterial defense via non-canonical LC3 decoration of extracellular bacteria. Microbes Infect. 105545. 10.1016/j.micinf.2025.105545.
Klimkaitė L., Drevinskaitė R., Krinickis K., Sužiedėlienė E., Armalytė J. (2025) Stenotrophomonas maltophilia of clinical origin display higher temperature tolerance comparing with environmental isolates. Virulence. 16(1):2498669. 10.1080/21505594.2025.2498669.
Konovalovas A., Armalytė J., Klimkaitė L., Liveikis T., Jonaitytė B., Danila E., Bironaitė D., Mieliauskaitė D., Bagdonas E., Aldonytė R. (2024) Insights into respiratory microbiome composition and systemic inflammatory biomarkers of bronchiectasis patients. Microbiol Spectr. 12(12):e0414423. 10.1128/spectrum.04144-23.
Konovalovas A., Armalytė J., Klimkaitė L., Liveikis T., Jonaitytė B., Danila E., Bironaitė D., Mieliauskaitė D., Bagdonas E., Aldonytė R. (2024) Human nasal microbiota shifts in healthy and chronic respiratory disease conditions. BMC Microbiol. 24(1):150. 10.1186/s12866-024-03294-5
Danne, C., Skerniskyte, J., Marteyn, B., and Sokol, H. (2024). Neutrophils: from IBD to the gut microbiota. Nat Rev Gastroenterol Hepatol 21, 184–197. 10.1038/s41575-023-00871-3.
Armalytė, J., Čepauskas, A., Šakalytė, G., Martinkus, J., Skerniškytė, J., Martens, C., Sužiedėlienė, E., Garcia-Pino, A., and Jurėnas, D. (2023). A polyamine acetyltransferase regulates the motility and biofilm formation of Acinetobacter baumannii. Nat Commun 14, 3531. 10.1038/s41467-023-39316-5.
Klimkaite, L., Liveikis, T., Kaspute, G., Armalyte, J., and Aldonyte, R. (2023). Air pollution-associated shifts in the human airway microbiome and exposure-associated molecular events. Future Microbiol 18, 607–623. 10.2217/fmb-2022-0258.
Klimkaitė, L., Ragaišis, I., Krasauskas, R., Ružauskas, M., Sužiedėlienė, E., and Armalytė, J. (2023). Novel Antibiotic Resistance Genes Identified by Functional Gene Library Screening in Stenotrophomonas maltophilia and Chryseobacterium spp. Bacteria of Soil Origin. Int J Mol Sci 24, 6037. 10.3390/ijms24076037.
Buchovec, I., Klimkaitė, L., Sužiedėlienė, E., and Bagdonas, S. (2022). Inactivation of Opportunistic Pathogens Acinetobacter baumannii and Stenotrophomonas maltophilia by Antimicrobial Photodynamic Therapy. Microorganisms 10, 506. 10.3390/microorganisms10030506.
Buchovec, I., Vyčaitė, E., Badokas, K., Sužiedelienė, E., and Bagdonas, S. (2022). Application of Antimicrobial Photodynamic Therapy for Inactivation of Acinetobacter baumannii Biofilms. Int J Mol Sci 24, 722. 10.3390/ijms24010722.
Polmickaitė-Smirnova, E., Buchovec, I., Bagdonas, S., Sužiedėlienė, E., Ramanavičius, A., and Anusevičius, Ž. (2022). Photoinactivation of Salmonella enterica exposed to 5-aminolevulinic acid: Impact of sensitization conditions and irradiation time. Journal of Photochemistry and Photobiology B: Biology 231, 112446. 10.1016/j.jphotobiol.2022.112446.
Lastauskienė, E., Valskys, V., Stankevičiūtė, J., Kalcienė, V., Gėgžna, V., Kavoliūnas, J., Ružauskas, M., and Armalyte, J. (2021). The Impact of Intensive Fish Farming on Microbiome and Resistome of Pond Sediments. Front. Vet. Sci. 8. 10.3389/fvets.2021.673756.
Skerniškytė, J., Karazijaitė, E., Lučiūnaitė, A., and Sužiedėlienė, E. (2021). OmpA Protein-Deficient Acinetobacter baumannii Outer Membrane Vesicles Trigger Reduced Inflammatory Response. Pathogens 10, 407. 10.3390/pathogens10040407.
Klimkaitė, L., Armalytė, J., Skerniškytė, J., and Sužiedėlienė, E. (2020). The Toxin-Antitoxin Systems of the Opportunistic Pathogen Stenotrophomonas maltophilia of Environmental and Clinical Origin. Toxins (Basel) 12. 10.3390/toxins12100635.
Krasauskas, R., Skerniškytė, J., Martinkus, J., Armalytė, J., and Sužiedėlienė, E. (2020). Capsule Protects Acinetobacter baumannii From Inter-Bacterial Competition Mediated by CdiA Toxin. Front Microbiol 11, 1493. 10.3389/fmicb.2020.01493.
Armalytė, J., Skerniškytė, J., Bakienė, E., Krasauskas, R., Šiugždinienė, R., Kareivienė, V., Kerzienė, S., Klimienė, I., Sužiedėlienė, E., and Ružauskas, M. (2019). Microbial Diversity and Antimicrobial Resistance Profile in Microbiota From Soils of Conventional and Organic Farming Systems. Front Microbiol 10, 892. 10.3389/fmicb.2019.00892.
Krasauskas, R., Skerniškytė, J., Armalytė, J., and Sužiedėlienė, E. (2019). The role of Acinetobacter baumannii response regulator BfmR in pellicle formation and competitiveness via contact-dependent inhibition system. BMC Microbiol. 19, 241. 10.1186/s12866-019-1621-5.
Miškinytė, M., Juškaitė, R., Skerniškytė, J., Voldemarienė, V., Valuckas, K.P., Kučinskienė, Z.A., Sužiedėlis, K., and Sužiedėlienė, E. (2019). High incidence of plasmid-mediated quinolone resistance (PMQR) genes among antibiotic-resistant Gram-negative bacteria from patients of the Lithuanian National Cancer Center. Infect Dis (Lond) 51, 471–474. 10.1080/23744235.2019.1591637.
Skerniškytė, J., Krasauskas, R., Péchoux, C., Kulakauskas, S., Armalytė, J., and Sužiedėlienė, E. (2018). Surface-Related Features and Virulence Among Acinetobacter baumannii Clinical Isolates Belonging to International Clones I and II. Front Microbiol 9, 3116. 10.3389/fmicb.2018.03116.
Skerniškytė, J., Karazijaitė, E., Deschamps, J., Krasauskas, R., Armalytė, J., Briandet, R., and Sužiedėlienė, E. (2019). Blp1 protein shows virulence-associated features and elicits protective immunity to Acinetobacter baumannii infection. BMC Microbiol. 19, 259. 10.1186/s12866-019-1615-3.
Skerniškytė, J., Karazijaitė, E., Deschamps, J., Krasauskas, R., Briandet, R., and Sužiedėlienė, E. (2019). The Mutation of Conservative Asp268 Residue in the Peptidoglycan-Associated Domain of the OmpA Protein Affects Multiple Acinetobacter baumannii Virulence Characteristics. Molecules 24, 1972. 10.3390/molecules24101972.
Nukleorūgščių biochemijos laboratorija:
- Vepštaitė-Monstavičė I, Lukša-Žebelovič J, Apšegaitė V, Mozūraitis R, Lisicinas R, Stanevičienė R, Blažytė-Čereškienė L, Serva S, Servienė E. Profiles of Killer Systems and Volatile Organic Compounds of Rowanberry and Rosehip-Inhabiting Yeasts Substantiate Implications for Biocontrol. Foods. 2025 Jan 16;14(2):288. doi: 10.3390/foods14020288.
- Celitan E, Stanevičienė R, Servienė E and Serva S (2024) Highly stable Saccharomyces cerevisiae L-BC capsids with versatile packing potential. Bioeng. Biotechnol. 12:1456453. doi: 10.3389/fbioe.2024.1456453.
- Vepštaitė-Monstavičė I, Lukša J, Strazdaitė-Žielienė Ž, Serva S, Servienė E. Distinct microbial communities associated with health-relevant wild berries. Environ Microbiol Rep. 2024 Dec;16(6):e70048. doi: 10.1111/1758-2229.70048.
- Konovalovas, A., Armalytė, J., Klimkaitė, L., Liveikis, T., Jonaitytė, B., Danila, E., Bironaitė, D., Mieliauskaitė, D., Bagdonas, E. & Aldonytė, R. (2024). Human nasal microbiota shifts in healthy and chronic respiratory disease conditions. BMC Microbiology, 24(1), 150. https://doi.org/10.1186/s12866-024-03294-5.
- Konovalovas, A., Armalytė, J., Klimkaitė, L., Liveikis, T., Jonaitytė, B., Danila, E., Bironaitė, D., Mieliauskaitė, D., Bagdonas, E. & Aldonytė, R. (2024). Insights into respiratory microbiome composition and systemic inflammatory biomarkers of bronchiectasis patients. Microbiology Spectrum, 12(12), e04144-23. https://doi.org/10.1128/spectrum.04144-23.
- Zebrauskiene, D., Sadauskiene, E., Dapkunas, J., Kairys, V., Balciunas, J., Konovalovas, A., Masiuliene, R., Petraityte, G., Valeviciene, N., Mataciunas, M., Barysiene, J., Mikstiene, V., Tomkuviene, M. & Preiksaitiene, E. (2024). Aortic disease and cardiomyopathy in patients with a novel DNMT3A gene variant causing Tatton-Brown–Rahman syndrome. Clinical Epigenetics, 16(1), 76. https://doi.org/10.1186/s13148-024-01686-y.
- Macedo DH, Grybchuk D, Režnarová J, Votýpka J, Klocek D, Yurchenko T, Ševčík J, Magri A, Dolinská MU, Záhonová K, Lukeš J, Servienė E, Jászayová A, Serva S, Malysheva MN, Frolov AO, Yurchenko V, Kostygov AY. Diversity of RNA viruses in the cosmopolitan monoxenous trypanosomatid Leptomonas pyrrhocoris. BMC Biol. 2023 Sep 12;21(1):191. doi: 10.1186/s12915-023-01687-y.
- Servienė E, Serva S. Recent Advances in the Yeast Killer Systems Research. Microorganisms. 2023 May 1;11(5):1191. https://doi.org/10.3390/microorganisms11051191.
- Merkys, A., Vaitkus, A., Grybauskas, A., Konovalovas, A., Quirós, M. & Gražulis, S. (2023). Graph isomorphism-based algorithm for cross-checking chemical and crystallographic descriptions. Journal of Cheminformatics, 15(1), 25. https://doi.org/10.1186/s13321-023-00692-1.
- Lingė, D., Gedgaudas, M., Merkys, A., Petrauskas, V., Vaitkus, A., Grybauskas, A., Paketurytė, V., Zubrienė, A., Zakšauskas, A., Mickevičiūtė, A., Smirnovienė, J., Baranauskienė, L., Čapkauskaitė, E., Dudutienė, V., Urniežius, E., Konovalovas, A., Kazlauskas, E., Shubin, K., Schiöth, H. B., Matulis, D. (2023). PLBD: protein–ligand binding database of thermodynamic and kinetic intrinsic parameters. Database, https://doi.org/10.1093/database/baad040.
- Lukša, J.; Celitan, E.; Servienė, E.; Serva, S. Association of ScV-LA Virus with Host Protein Metabolism Determined by Proteomics Analysis and Cognate RNA Sequencing. Viruses 2022, 14, 2345. https://doi.org/10.3390/v14112345.
- Grybchuk D, Procházková M, Füzik T, Konovalovas A, Serva S, Yurchenko V, Plevka P. Structures of L-BC virus and its open particle provide insight into Totivirus capsid assembly. Commun Biol. 2022 Aug 20;5(1):847. doi: 10.1038/s42003-022-03793-z.
- Saura A, Zakharova A, Klocek D, Gerasimov ES, Butenko A, Macedo DH, Servienė E, Zagirova D, Meshcheryakova A, Rogozin IB, Serva S, Kostygov AY, Yurchenko V. Elimination of LRVs Elicits Different Responses in Leishmania spp. mSphere. 2022 Aug 9:e0033522. doi: 10.1128/msphere.00335-22.
- Ravoityte, B.; Lukša, J.; Wellinger, R.E.; Serva, S.; Serviene, E. Adaptive Response of Saccharomyces Hosts to Totiviridae L-A dsRNA Viruses Is Achieved through Intrinsically Balanced Action of Targeted Transcription Factors. Fungi 2022, 8, 381. doi: 10.3390/jof8040381.
- Aitmanaitė L, Konovalovas A, Medvedevas P, Servienė E, Serva S. Specificity Determination in Saccharomyces cerevisiae Killer Virus Systems. Microorganisms. 2021 Jan 23;9(2):236. doi: 10.3390/microorganisms9020236.
- Ravoitytė B, Lukša J, Yurchenko V, Serva S, Servienė E. Saccharomyces paradoxus Transcriptional Alterations in Cells of Distinct Phenotype and Viral dsRNA Content. Microorganisms. 2020 Nov 30;8(12):E1902. doi: 10.3390/microorganisms8121902.
Atsparumo priešvėžiniam poveikiui molekulinių mechanizmų tyrimai:
Lysosome-targeted photodynamic treatment induces primary keratinocyte differentiation. Daugelaviciene N, Grigaitis P, Gasiule L, Dabkeviciene D, Neniskyte U, Sasnauskiene A. J Photochem Photobiol B. 2021 May;218:112183. doi: 10.1016/j.jphotobiol.2021.112183. Epub 2021 Mar 29. PMID: 33831753
Notch and Endometrial Cancer. Jonusiene V, Sasnauskiene A. Adv Exp Med Biol. 2021;1287:47-57. doi: 10.1007/978-3-030-55031-8_4. PMID: 33034025 Review.
Exogenous interleukin-1α signaling negatively impacts acquired chemoresistance and alters cell adhesion molecule expression pattern in colorectal carcinoma cells HCT116. Grigaitis P, Jonusiene V, Zitkute V, Dapkunas J, Dabkeviciene D, Sasnauskiene A. Cytokine. 2019 Feb; 114:38-46. doi: 10.1016/j.cyto.2018.11.031. Epub 2018 Dec 22. PMID: 30583087
Significance of Notch and Wnt signaling for chemoresistance of colorectal cancer cells HCT116. Kukcinaviciute E, Jonusiene V, Sasnauskiene A, Dabkeviciene D, Eidenaite E, Laurinavicius A. J Cell Biochem. 2018 Jul;119(7):5913-5920. doi: 10.1002/jcb.26783. Epub 2018 Apr 10. PMID: 29637602
Effect of mTHPC-mediated photodynamic therapy on 5-fluorouracil resistant human colorectal cancer cells. Kukcinaviciute E, Sasnauskiene A, Dabkeviciene D, Kirveliene V, Jonusiene V. Photochem Photobiol Sci. 2017 Jul 1;16(7):1063-1070. doi: 10.1039/c7pp00014f. Epub 2017 May 16. PMID: 28509917
Molekuliniai viduląstelinės pernašos mechanizmai:
Kaipa JM, Starkuviene V, Erfle H, Eils R, Gladilin E. Transcriptome profiling reveals Silibinin dose-dependent response network in non-small lung cancer cells. PeerJ. 2020 Dec 16;8:e10373. doi: 10.7717/peerj.10373.
Liu, SJ; Majeed, W; Grigaitis, P; Betts, MJ; Climer, LK; Starkuviene, V; Storrie, B. Epistatic Analysis of the Contribution of Rabs and Kifs to CATCHR Family Dependent Golgi Organization. Front Cell Dev Bio, 2019, Aug 2;7:126. doi: 10.3389/fcell.2019.00126.
Starkuviene, V., Kallenberger, SM., Beil, N., Lisauskas, T., Schumacher, BS., Bulkescher, R., Wajda, P., Gunkel, M., Beneke, J., Erfle, H. (2019) High-Density Cell Arrays for Genome-Scale Phenotypic Screening. SLAS Discov. 2019 Mar;24(3):274-283. doi: 10.1177/2472555218818757.
Bulkescher, R., Starkuviene, V., & Erfle, H. (2017) Solid-phase reverse transfection for intracellular delivery of functionally active proteins. Genome Res. 2017 Oct;27(10):1752-1758. doi: 10.1101/gr.215103.
Gunkel, M., Erfle, H., & Starkuviene, V. (2016). High-Content Analysis of the Golgi Complex by Correlative Screening Microscopy. Methods Mol Biol, 111-121.
MOKSLO SKLAIDA
Bakterijų atsparumo antibiotikams molekuliniai mechanizmai, streso atsakai ir patogenezė:
https://www.lrt.lt/naujienos/mokslas-ir-it/11/2364820/atsparumo-antibiotikams-krize-iki-2050-m-gali-mirti-40-mln-zmoniu
https://issuu.com/vu_lt/docs/spectrum_40_numeris
https://www.15min.lt/verslas/naujiena/mokslas-it/oportunistines-infekcijos-kam-pavojingos-ir-kaip-nuo-ju-apsisaugoti-1290-2142716
https://www.15min.lt/verslas/naujiena/mokslas-it/mokslininkes-paaiskino-kodel-israndama-vis-maziau-antibiotiku-o-atsparumas-jau-turimiems-dideja-1290-2030438
https://www.vu.lt/naujienos/spectrum/straipsniai/virusines-nanostrukturos-universalus-irankis-vakcinoms-kurti
https://www.lrt.lt/mediateka/irasas/2000197094/mokslas-skubantiems-ar-lietuvoje-jau-reikia-sunerimti-del-antibiotikams-atspariu-organizmu
https://www.lrt.lt/naujienos/mokslas-ir-it/11/2212102/lietuves-tyrejos-straipsnis-apie-imuniteto-ir-mikrobiotos-saveika-prestiziniame-nature-reviews-zurnale
Nukleorūgščių biochemijos laboratorija
2022.09.30 Lietuvos Biochemikų Draugijos minikonferencijos VU GMC organizavimas.
2023.05.05-06 The 2023 FEBS Education Ambassadors Meeting VU GMC organizavimas.
2023.05.24-25 Andriaus Sniadeckio Memorialinės Konferencijos „Molekulinių gyvybės mokslų pasiekimai“ (JSMC-2023) organizavimas.
2023.06.28-30 Lietuvos Biochemikų Draugijos konferencijos Taujėnų dvare organizavimas.
2025.04.23-25 FEBS3+ Baltics: Biochemistry at the Fore Line konferencijos VU GMC organizavimas.
DARBUOTOJAI
|
Darbuotojas |
Pareigos |
Kontaktai |
Skaitomi kursai |
Mokslinės publikacijos ir konferencijos |
|
Katedros vedėja, docentė, mokslo darbuotoja |
||||
| Dr. Lina Aitmanaitė | Asistentė, mokslo darbuotoja | |||
| Dr. Julija Armalytė | Profesorė, vyresnioji mokslo darbuotoja | |||
| Jolanta Bagvilė | Jaunesnioji administratorė |
|
||
| Dr. Enrika Celitan | Jaunesnioji mokslo darbuotoja, lektorė | |||
| Gerda Jasinevičienė | Jaunesnioji asistentė | |||
| Andrius Jasinevičius | Jaunesnysis asistentas, laborantas, doktorantas | |||
| Dr. Violeta Jonušienė | Docentė, vyresnioji mokslo darbuotoja | |||
| Laurita Klimkaitė | Jaunesnioji mokslo darbuotoja, jaunesnioji asistentė | |||
| Dr. Aleksandras Konovalovas | Vyresnysis mokslo darbuotojas | |||
| Tomas Liveikis | Jaunesnysis mokslo darbuotojas, laborantas | |||
| Dr. Arvydas Markuckas | Docentas | |||
| Dr. Algirdas Mikalkėnas | Asistentas, biologas tyrėjas | |||
| Ramutė Pagalytė | Vyresnioji laborantė | |||
| Ignas Ragaišis | Jaunesnysis asistentas | |||
| Dr. Saulius Serva | Profesorius | |||
| Dr. Jūratė Skerniškytė | Vyresnioji mokslo darbuotoja | |||
| Prof. Vytautė Starkuvienė-Erfle | Profesorė | |||
| Dr. (HP) Edita Sužiedėlienė | Profesorė | |||
| Dr. (HP) Kęstutis Sužiedėlis | Profesorius | |||
| Dr. Aurelijus Zimkus | Biologas tyrėjas | |||
| Dr. Eglė Žalytė | Asistentė, mokslo darbuotoja | |
|
|
| Zigmantas Žitkus | Lektorius | |||
| Dr. Vilmantė Žitkutė | Mokslo darbuotoja, asistentė | |||
| Kviestiniai dėstytojai | ||||
| Dr. Martina Rudgalvytė | Asistentė (Briuselio laisvasis universitetas, Belgija) | |||
PARTNERIAI
Bakterijų atsparumo antibiotikams molekuliniai mechanizmai, streso atsakai ir patogenezė:
- Dr. Irina Buchovec (Vilniaus Universitetas, Fizikos fakultetas, Fotonikos ir nanotechnologijų institutas (Šviesos technologijų taikymas biomedicinoje ir maisto saugoje, patogeninių mikroorganizmų inaktyvacija antimikrobine fotodinamine terapija)).
- Prof. Edvardas Danila (Vilniaus universiteto ligoninė Santaros klinikos, Pulmonologijos ir alergologijos centras (Žmogaus kvėpavimo takų mikrobiomo tyrimai)).
- Doc. Silvija Kiverytė (Vilniaus universiteto ligoninė Santaros klinikos, Laboratorinės medicinos centras (Atsparumo antibiotikams genetinių determinančių plitimas ir evoliucija klinikoje)).
- Doc. Agnė Kirkliauskienė (Vilniaus Universitetas, Medicinos fakultetas (Atsparumo antibiotikams genetinių determinančių plitimas ir evoliucija klinikoje)).
- Prof. Modestas Ružauskas (Lietuvos sveikatos mokslų universitetas, Veterinarijos fakultetas, Mikrobiologijos ir virusologijos institutas (Antibiotikams atsparių bakterijų paplitimas aplinkoje)).
Nukleorūgščių biochemijos laboratorija:
- Dr. Elena Servienė (Genetikos laboratorija, Gamtos tyrimų centras, Vilnius)
- Dr. Vytautė Starkuvienė-Erfle (BioQuant, Heidelberg University, Heidelberg, Germany)
- Dr. Vyacheslav Yurchenko (Life Science Research Centre, University of Ostrava, Czech Republic)
Atsparumo priešvėžiniam poveikiui molekulinių mechanizmų tyrimai:
- Dr. Vida Časaitė (VU GMC Biochemijos institutas)
- Dr. Eglė Preikšaitienė (VU Medicinos fakultetas Biomedicinos mokslų institutas)
- Dr. Vytautė Starkuvienė (BioQuant, Heidelberg University, Heidelberg, Germany)
Molekuliniai viduląstelinės pernašos mechanizmai:
- Dr. R. Valiokas, FTMC
- Prof. Dr. Med. M. Keese, Universitetinė Mannheim Klinika, Heidelberg Universitetas
- Prof. S. Serva, Vilniaus Universitetas
- Dr. A. Sasnauskienė, Vilniaus Universitetas
STUDIJŲ PROGRAMOS
Biochemija
| Biochemija – mokslas, nagrinėjantis cheminius procesus gyvuose organizmuose ir šiais procesais paremtus gyvybės pagrindus. Didžiuojamės, kad Vilniaus universitetas jau daugiau nei 60-imt metų – nuo 1962 m., yra Lietuvos biochemikų kalvė! |  |
|
Norintys studijuoti biochemiją bakalauro pakopoje, stoja į Vilniaus universiteto Chemijos ir geomokslų fakulteto Biochemijos bakalauro programą . Norintys studijuoti biochemiją magistro pakopoje, stoja į Biochemijos magistro programą, kuri vykdoma Vilniaus universiteto Gyvybės mokslų centre. Vilniaus universiteto Gyvybės mokslų centre taip pat vykdomos ir Biochemijos doktorantūros (III pakopos) studijos. Daugiau informacijos |
 |
Kur ir kuo dirba biochemikai ?
- Mokslininkais: Lietuvos ir užsienio mokslo centruose;
- Mokslininkais ir dėstytojais: Lietuvos ir užsienio universitetuose;
- Projektų vadovais, specialistais, vadybininkais: tarptautinėse ir Lietuvos gyvybės mokslų, biotechnologijos, biofarmacijos verslo įmonėse ir startuoliuose;
- Specialistais: medicinos, biologijos, diagnostikos laboratorijose;
- Projektų vadovais, specialistais, vadybininkais: aukštųjų technologijų įrangos prekybos ir aptarnavimo srityse.
Molekulinė biologija
|
Molekulinė biologija – jaunas mokslas, tačiau jo istorija stulbina atradimais, o šio mokslo žinių ir jomis paremtų biotechnologijų įtaka mūsų gyvenimui – didžiulė. 1953 metai, kai buvo išaiškinta pagrindinės gyvybės molekulės – DNR – struktūra, laikomi molekulinės biologijos gimimo metais. Vienas DNR struktūros atradėjų, Fransis Krikas pasakė – “Nepažinę molekulių, galime turėti tik labai paviršutinišką supratimą apie gyvybę”. Kuo molekulinė biologija skiriasi nuo biochemijos? Biochemija gilinasi į chemines reakcijas, vykstančias gyvose sistemose. Juokaujama, kad biochemikai „(ne)bijo chemijos“. Pavyzdžiui, ląstelėse vykstančias chemines reakcijas katalizuoja biologinės molekulės, fermentai. Molekulinė biologija gilinasi į tokių molekulių struktūrą, sąveiką su kitomis molekulėmis, jų vietą ląstelėje. Tad, biochemija ir molekulinė biologija turi gana daug bendro. Kuo molekulinė biologija skiriasi nuo biologijos? Biologija tiria biologines rūšis, jų įvairovę, evoliuciją. Tačiau molekulinės biologijos žinios ir jų taikymas skverbiasi ir į biologiją: šiandien rūšies tapatybę tiksliai galima nustatyti molekulinės biologijos metodais – prieš keliasdešimt metų tai buvo neįsivaizduojama. Kodėl verta būti molekuliniu biologu? Didžiausias molekulinių biologų iššūkis 21-ajame amžiuje – išaiškinti visus molekulinius procesus, vykstančius gyvuose organizmuose. Šio iššūkio dalyviais neabejotinai galite tapti ir Jūs, pasirinkę molekulinės biologijos studijas Vilniaus universiteto Gyvybės mokslų centre! |
 |
|
“Molekulių” – taip linksmai vadinami molekulinės biologijos programų studentai – laukia įdomios paskaitos ir praktikos darbai, eksperimentiniai tyrimai mokslinėse laboratorijose, turiningas studentiškas laisvalaikis, o pabaigę studijas molekuliniai biologai laukiami gyvybės mokslų centruose, biotechnologijų, biofarmacijos ir kitose aukštųjų technologijų įmonėse, biomedicinos įstaigose, mokslo ir technologijų parkuose. Norintys studijuoti molekulinę biologiją bakalauro pakopoje, stoja į Vilniaus universiteto Gyvybės mokslų centro Molekulinės biologijos bakalauro programą. Norintys studijuoti molekulinę biologiją magistro pakopoje, stoja į Vilniaus universiteto Gyvybės mokslų centro Molekulinės biologijos magistro programą. Norintys tęsti studijas doktorantūros pakopoje, stoja į Vilniaus universiteto Gyvybės mokslų centre vykdomas Biochemijos ar Biologijos doktorantūros studijas. Daugiau informacijos. |
 |
Kur ir kuo dirba molekuliniai biologai?
- Mokslininkais: Lietuvos ir užsienio mokslo centruose;
- Mokslininkais ir dėstytojais: Lietuvos ir užsienio universitetuose;
- Projektų vadovais, specialistais, vadybininkais: tarptautinėse ir Lietuvos gyvybės mokslų, biotechnologijos, biofarmacijos verslo įmonėse ir startuoliuose;
- Specialistais: medicinos, biologijos, diagnostikos laboratorijose, maisto pramonės įmonėse, aplinkosaugos, visuomenės sveikatos, žemės ūkio, veterinarijos tarnybose;
- Projektų vadovais, specialistais, vadybininkais: aukštųjų technologijų įrangos prekybos ir aptarnavimo srityse.
